
Obiettivo:
Determinare come varia la pressione al variare della temperatura
Strumenti:
Becher contenente acqua, sostegno, Treppiedi, becco Bunsen, ampolla, tubo di adduzione, manometro ad "U", termometro, un agitatore o una bacchetta di vetro.
Modalità:
Sistemare il becco Bunsen sotto il treppiedi, che sostiene il becher. Nel becher immergere completamente l'ampolla mantenuta dal sostegno.
Collegare ad un'estremità del tubo d'adduzione l'ampolla, nell'altra il manometro. Inserire nella tabella i dati
di temperatura dell'acqua (si consideri la temperatura dell'acqua uguale a quella del gas), e della pressione rilevata dal manometro. Accendere il becco Bunsen, controllare con il termometro la temperatura ed, ad intervalli regolari di temperatura (es. ogni 15°C), agitare con un agitatore o un'asta, l'acqua per rendere omogenea la temperatura. Leggere la temperatura e la pressione rilevata dal manometro. Rieseguire tale operazione più volte.
Modalità di lettura del manometro ad "U".
Per leggere la pressione con questo tipo di manometro bisogna fare la differenza di millimetri tra il braccio con l'uscita aperta
e il braccio con l'uscita collegato ad uno strumento (nel nostro caso l'ampolla). A tale valore bisogna aggiungere il valore, in millimetri di mercurio (mmHg), della pressione atmosferica, rilevata con un barometro.
Modellino:

Tabella:
|
|
|
|
||
|
|
|
|
||
|
1
|
19
|
0
|
737
|
737
|
|
2
|
25
|
10
|
737
|
747
|
|
3
|
32
|
20
|
737
|
757
|
|
4
|
41
|
45
|
737
|
782
|
|
5
|
50
|
55
|
737
|
792
|
Grafico:
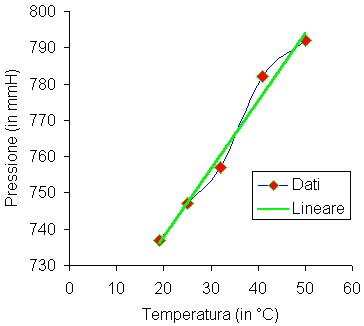
Conclusioni:
Dal grafico notiamo che il fenomeno ha un andamento lineare, cioè le due grandezze sono direttamente proporzionali. Tale fenomeno può essere spiegato a livello di particelle dicendo che nel sistema, aumentando la temperatura, cioè l'energia del sistema e quindi la violenza degli urti, aumenta la pressione poiché le pareti sono sottoposte ad una forza maggiore. Esperimenti di questo genere, effettuati moltissime volte, furono eseguiti da Jacques Charles che nel 1787 elaborò la legge isocora (a volume costante) secondo la quale "riscaldando un gas
a volume costante si provoca un aumento della pressione; per ogni grado
centigrado di temperatura la pressione aumenta di 1/273 della pressione
che il gas esercitava a 0 °C" in formula: p = p0 * (1+ 1/273 * t) Dove: p = pressione alla temperatura t (in °C), p0 = pressione a 0 °C e t = Temperatura in °C.